맞춤형 치료 전략 제시
|
|
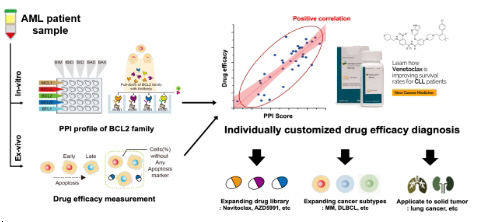
연구팀은 BCL2 단백질군 내 PPI 네트워크로 대변되는 단백질 복합체의 역동성에 주목해 BH3 모사체의 세포자살 조절 기전을 분석했다. 이에 연구팀은 단분자 공면역침강으로 구성된 SMPC 기법을 개발, 총 22종의 BCL2 계열 PPI 신호 검출 방법을 확립했다.단분자 형광 이미징 기법을 활용한 해당 기술은 높은 민감성을 바탕으로 약 3만 여개의 미량 세포 검체로부터 개별 PPI 신호의 정량적 분석이 가능하다.
연구팀은 세포자살의 진행에 따른 AML 세포주 내 PPI 네트워크의 변화를 정량적으로 추적했다. 세균 독소에 의해 유도되는 일반적인 세포자살 과정에서 AML 세포의 생존에는 BCL2-BAX 단백질 복합체가 주요 매개체로 작동한다.
특히 ABT-199는 BCL2 단백질에 선택적으로 결합, 해당 복합체를 해리하여 활성화 BAX 단백질의 상승을 유도하는 것으로 세포자살을 야기함이 확인됐다. 연구팀은 해당 결과를 바탕으로 기존에 명확하게 설명되지 않는 ABT-199의 작동 기전 (Mode of action)의 핵심 과정을 밝혀냈다.
연구팀은 32명의 실제 AML 환자로부터 공여받은 검체를 대상으로 대규모 PPI 신호 프로파일링을 수행했다. 획득한 다차원 PPI 프로파일 데이터는 동일 코호트의 ABT-199에 대한 생체 외 수준 약물 반응성과의 상관관계 분석을 통해 ABT-199 반응성에 영향을 주는 주요 지표인 BCL2-BAX 복합체 및 BCLxL-BAK 복합체가 검출됐다.
연구팀은 개별 AML 환자의 ABT-199 약물 반응성을 높은 정확도로 예측하는 바이오마커 개발에 성공했다.
서울대 관계자는 "연구를 통해 개발한 바이오마커가 AML 환자의 치료 결정에 중요한 가이드라인이 되어 환자 개개인에게 맞춤형 치료 전략을 제시함으로써 보다 효과적인 치료를 제공할 수 있을 것"이라고 기대했다.